Ontogenèse de l’axe gonadotrope
– Différenciation du lignage gonadotrope hypophysaire (PI : David L’Hôte)
La spécification du lignage gonadotrope, un processus clé pour la fertilité, dépend de cascades complexes de signalisation et de transcription qui ont lieu pendant l’embryogenèse et dont les mécanismes moléculaires restent mal connus.
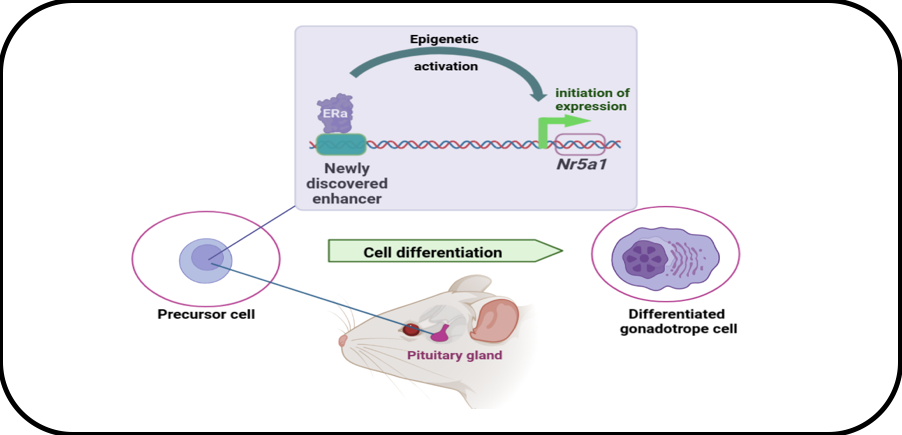
Nous avons étudié la régulation du gène Nr5a1 codant le facteur le plus précoce impliqué dans la spécification des cellules gonadotropes. Cette étude a été effectuée sur un ensemble de lignées cellulaires, constituant un modèle de différenciation des cellules gonadotropes, par des approches d’analyse génomique fonctionnelle de pointe telles que l’évaluation de l’accessibilité de la chromatine (ATAC-Seq), l’édition du génome (CRISPR/Cas9) et la Capture de la Conformation de la Chromatine (3C). Nous avons démontré que l’initiation de l’expression de Nr5a1 dépend d’un nouvel enhancer, une région génomique régulatrice distale, qui est activée de manière transitoire au cours du développement de l’hypophyse. Nous avons également montré que l’activité de l’enhancer est contrôlée par le récepteur alpha des œstrogènes (ERα), en accord avec le rôle émergeant d’ERα comme régulateur majeur chromatinien. Les recherches actuelles visent à comprendre les mécanismes d’action d’ERα en identifiant ses partenaires dans les cellules gonadotropes en cours de différenciation.
Rôle d’ERa dans les mécanismes épigénétiques contrôlant l’expression du gène Nr5a1 dans les cellules gonadotropes immatures.
DOI: 10.1186/s13072-019-0291-8
– Activation de l’axe gonadotrope pendant la minipuberté (PI : Céline Guigon)
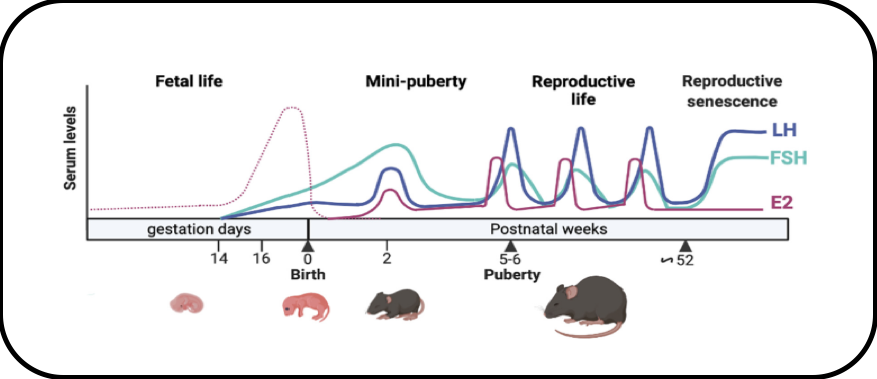
Chez les mammifères femelles, la minipuberté dans l’enfance est caractérisée par une activation forte et transitoire de l’axe hypothalamus-hypophyse-ovaire. Nous avons effectué des analyses approfondies des profils endocriniens pendant la minipuberté chez la souris et étudié la régulation de la production intra-ovarienne d’oestradiol. Nous avons identifié de nouveaux mécanismes par lesquels les niveaux élevés de FSH stimulent la production d’estradiol ovarienne lors de la minipuberté, notamment par l’intermédiaire d’une baisse de l’AMH, sans affecter la croissance folliculaire.
Notre recherche actuelle (financement ANR Reprofun) vise à évaluer le rôle possible de la minipuberté dans la programmation de la fertilité féminine.
Ces travaux sont menés en collaboration avec S. Mhaouty-Kodja (Neuroscience Paris Seine, Sorbonne Université).
Activité de l’axe gonadotrope tout au long de la vie chez la souris
DOI: 10.1530/JOE-18-0313
Régulation de l’axe gonadotrope
– Caractérisation des mécanismes moléculaires impliqués dans la plasticité de la cellule gonadotrope au cours du cycle œstrien (PIs : David L’Hôte et Ghislaine Garrel)
Au cours du cycle sexuel chez la femelle, les cellules gonadotropes hypophysaires font preuve d’une remarquable plasticité endocrinienne qui orchestre l’activité cyclique de l’ovaire ovarienne et ainsi, la coordination du fonctionnement des organes reproducteurs féminins. Au cours de chaque cycle œstrien cette plasticité culmine pour générer une libération massive de LH et de FSH, essentielle à la fertilité féminine puisqu’elle déclenche l’ovulation. Les mécanismes moléculaires permettant l’intégration par les cellules gonadotropes in vivo de tous les signaux régulateurs à l’origine de leur plasticité sont loin d’être élucidés, principalement en raison de la complexité structurelle de l’hypophyse.
Nous avons donc réalisé des analyses RNA-seq en noyau unique à partir d’hypophyses de rattes prélevées à différents moments du cycle œstrien afin d’élucider les changements transcriptionnels qui ont lieu spécifiquement dans les cellules gonadotropes. Des variations transcriptionnelles significatives ont été détectées non seulement dans les cellules gonadotropes mais aussi dans la plupart des types de cellules endocrines et non endocrines de l’hypophyse suggérant que l’ensemble de la glande hypophysaire contribue à la régulation du cycle œstrien. En nous focalisant sur les cellules gonadotropes, nous avons observé que la plasticité transcriptionnelle a lieu principalement pendant le pro-œstrus et nous avons détecté des changements importants d’expression de familles de gènes inattendues qui font actuellement l’objet d’investigations.
Ce travail est réalisé en collaboration avec F. Miralles (Institut Cochin) et O. Taboureau (BFA).
– Régulation de la folliculogenèse ovarienne par l’estradiol (PI : Stéphanie Chauvin)
Alors que l’importance de l’estradiol (E2) dans le développement des follicules ovariens est bien établie, le rôle de ses récepteurs nucléaires ERα et ERβ dans la biologie des cellules de la granulosa (CG) reste mal compris, en particulier chez l’humain qui possède cinq isoformes d’ERβ. Nous avons démontré qu’ERβ1, ERβ2, ERβ4 et ERβ5 sont les isoformes d’ER prédominantes dans des cultures primaires de CG humaines et que l’E2 favorise une augmentation sélective de l’expression de certaines isoformes d’ERβ. Notre travail fournit également de nouvelles données dans le domaine de la signalisation œstrogénique, en particulier sur les différents rôles des isoformes d’ERβ dans le destin cellulaire. Nous avons, en effet, découvert les activités pro-apoptotiques des isoformes ERβ1, sensibles au ligand, et ERβ4, insensibles au ligand, dans une lignée de CG humaines.
Nos résultats mettent donc en évidence un rôle possible de l’E2 dans l’orientation du destin des CG en régulant spécifiquement l’expression relative des isoformes d’ERβ. L’E2 modulerait ainsi l’équilibre entre les molécules d’ERβ pro-apoptotiques et non-apoptotiques ce qui pourrait in fine contrôler la sélection des follicules.
Ce travail est réalisé en collaboration avec N. Chneiweiss et A. Mayeur, Unité de biologie de la reproduction, CECOS, Hôpital A. Béclère.
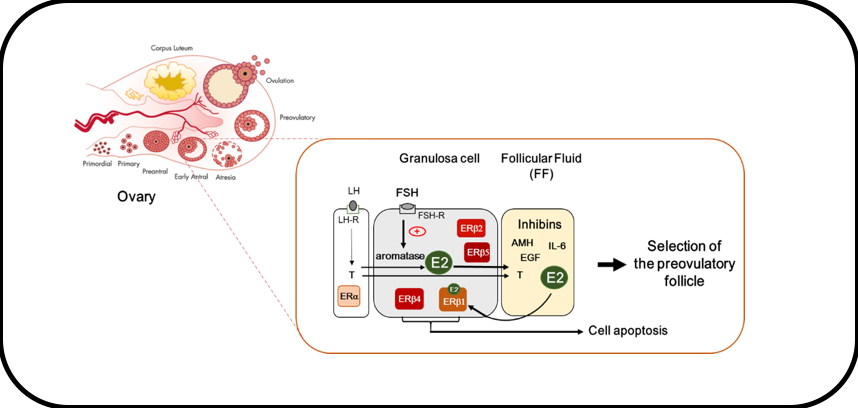
Modèle d’action d’E2 dans les cellules de la granulosa.
In GCs of small antral follicles, FSH stimulates the expression of the aromatase that converts thecal-derived androgens (i.e., testosterone (T) produced upon LH stimulation) to estrogens (E2). E2 contained in the follicular fluid (FF) synergizes with FSH to promote follicular growth and further participates in the selection of the dominant preovulatory follicle. Contrary to thecal cells that principally express ERα, GCs mainly express ERβ isoforms. Among them, only ERβ1 binds to E2. ERβ1 as well as ERβ4 possess pro-apoptotic activities that may influence follicle fate
DOI: 10.3390/ijms22095046
Vulnérabilité de l’axe gonadotrope
– Troubles métaboliques et activité gonadotrope hypophysaire (PIs : Ghislaine Garrel et Joëlle Cohen-Tannoudji)
L’obésité, dont la prévalence augmente dans le monde entier, perturbe la fertilité. L’obésité induite par la suralimentation, est associée à une inflammation de bas grade et il a été démontré que l’inflammation du tissu hypothalamique perturbe le contrôle central de l’homéostasie énergétique.
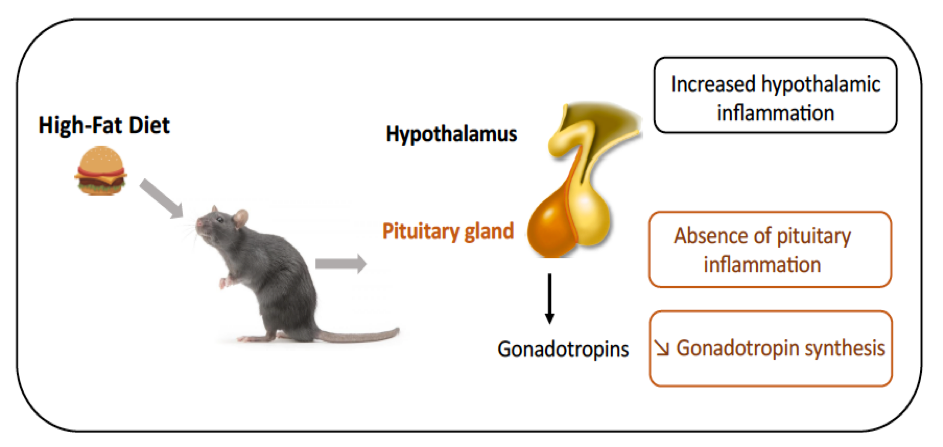
Ayant récemment montré que les acides gras sont détectés par l’hypophyse et peuvent modifier la synthèse des gonadotrophines, nous avons recherché si une inflammation hypophysaire pouvait contribuer aux altérations de la sécrétion des gonadotropines observées chez les patients obèses et dans des modèles animaux d’obésité induite par la suralimentation. Chez des rats mâles soumis, à court ou à long terme, à un régime riche en graisses (HFD), nous avons observé, comme attendu, une inflammation hypothalamique et une diminution de la synthèse et de la libération des gonadotropines. Ceci n’était cependant pas associé à une augmentation de l’expression génique des médiateurs inflammatoires dans l’hypophyse. Une supplémentation en DHA, un acide gras polyinsaturé oméga 3 ayant des propriétés anti-inflammatoires, atténue les troubles métaboliques et l’inflammation hypothalamique mais ne rétablit pas les niveaux circulants de gonadotropines. L’ensemble de ces travaux met en évidence une réponse inflammatoire différente de l’hypophyse à la suralimentation et une sensibilité accrue de l’axe de reproduction à la suralimentation.
L’analyse RNAseq sur cellule unique en cours (projet Lipophyse financé par l’IdEx) devrait apporter un nouvel éclairage sur les mécanismes moléculaires protégeant les cellules gonadotropes de l’inflammation induite par la suralimentation.
Ce travail est réalisé en collaboration avec C. Magnan et O. Taboureau (BFA).
Conséquences d’un régime riche en graisses sur l’inflammation hypophysaire et l’activité gonadotrope.
– Oestradiol et Syndrome des Ovaires polykystiques (PIs : Stéphanie Chauvin et Michaël Grynberg (Chef du service Médecine de la reproduction des hôpitaux A. Béclère et J. Verdier)
L’estradiol (E2) produit par les cellules de la granulosa (CG) des follicules antraux ovariens, régule la croissance et la sélection d’un follicule dominant tout en induisant le pic de gonadotropines nécessaire à l’ovulation. La dysovulation résultant de l’arrêt de la croissance et de la maturation des follicules antraux se produit chez près de 10 % des femmes en âge de procréer souffrant du syndrome des ovaires polykystiques (SOPK). Bien que les critères de diagnostic du SOPK soient clairement établis, l’étiologie moléculaire de ce syndrome fait toujours l’objet de débats. Dans une étude comparative récente, mesurant la concentration de stéroïdes présents à la fois dans les CG et le liquide folliculaire provenant de follicules appariés de femmes contrôle ou SOPK, nous avons montré que, contrairement au dogme actuel, les CG provenant de follicules SOPK présentent une biosynthèse normale de l’E2. La baisse de la concentration d’E2 dans le liquide folliculaire des follicules de femmes SOPK proviendrait plutôt d’une augmentation de sa dégradation dans le liquide folliculaire.
En outre, dans cette étude, nous fournissons de nouvelles caractéristiques du SOPK en révélant l’altération de la signalisation de l’E2 dans les CG des follicules des femmes SOPK, ce qui pourrait avoir un impact négatif sur l’émergence de follicules dominants, contribuant ainsi à leur infertilité.
– Oestradiol et tumeurs des cellules de la granulosa ovarienne (PI : Céline Guigon)
Les tumeurs des cellules de la granulosa (GCT) sont une forme rare et grave de cancer de l’ovaire, qui présentent un risque élevé de récidive tardive. Comme la plupart des patientes ont des niveaux élevés d’E2, nous avons étudié le rôle et les mécanismes d’action de l’E2 sur la croissance des GCT via ses récepteurs nucléaires (ERα et ERβ).
En utilisant des agonistes sélectifs d’ERα et ERβ sur des lignées humaines de GCT délétées des ERα ou ERβ, nous avons démontré que l’E2 favorise la croissance des cellules de GCT principalement par des mécanismes dépendants des ERα. L’E2 induit également la croissance des GCT via ERβ par des voies non génomiques mais ceci nécessite la présence d’ERα. Comme nous avons précédemment montré un rôle inhibiteur de l’E2 sur la dissémination des métastases des GCT via le récepteur des œstrogènes couplé aux protéines G (GPER), notre travail met en évidence la versatilité de l’action de l’E2 dans les GCT selon les différentes isoformes d’ER.
 Versatilité de l’action de l’E2 sur la croissance des GCT selon la nature du récepteur.
Versatilité de l’action de l’E2 sur la croissance des GCT selon la nature du récepteur.
DOI: 10.1002/path.5843
Les différents axes de recherche bénéficient du soutien technique de trois ingénieurs : E. AIraud, R. Corre et A. Pierre. Ces trois ingénieurs sont également impliqués dans des activités transversales au sein de l’unité BFA : E. Airaud est responsable du plateau FlexStation 3 de la Plate-forme Métabolisme; R. Corre est responsable des technologies in situ au sein de BFA et est également l’une des deux personnes compétentes en radioprotection de l’Unité ; A Pierre est la correspondante communication de BFA.