Contrôle Central du Comportement Alimentaire et de la Dépense Energétique
Responsable : Serge Luquet (DR CNRS)
Chez les mammifères, la régulation de l’homéostasie énergétique est finement régulée. En effet, malgré les fluctuations, la glycémie, le poids corporel et la teneur en graisses restent dans des fourchettes étroites et les perturbations induites par l’expérience se traduisent invariablement par un retour rapide aux « points de consigne » lorsque les conditions normales sont rétablies. Pour ce faire, des facteurs périphériques circulants, tels que des hormones (insuline, leptine, ghréline) et des nutriments (glucose, lipides), modulent rapidement des circuits neuronaux discrets qui déclenchent des changements dans le métabolisme de base et/ou les comportements alimentaires. La perturbation de ces circuits peut donner lieu à des conditions potentiellement mortelles qui incluent des maladies métaboliques telles que l’obésité et le diabète, tant chez l’homme que chez les rongeurs. Il est donc crucial de comprendre les mécanismes clés qui sous-tendent l’équilibre entre l’apport et la dépense d’énergie. L’approche centrale de notre équipe, Contrôle Central du Comportement Alimentaire et de la Dépense Energétique (C3ADE), consiste à exploiter la puissance des outils modernes de génétique moléculaire dans des approches intégrées afin de disséquer in vivo les bases physiologiques, cellulaires et moléculaires par lesquelles le dialogue entre le cerveau et les organes périphériques aboutit à une régulation adaptative des différents paramètres de l’équilibre énergétique, notamment dans ses composantes hédoniques, motivationnelles et sensorielles, l’efficacité métabolique et la réponse allostatique.
Les circuits homéostatiques et de récompense collaborent intimement à la mise en place de réponses adaptatives aux changements de disponibilité des nutriments et sont, directement et indirectement, contrôlés par des signaux extrinsèques (signaux sensoriels, y compris les odeurs), des facteurs cognitifs (stress, signaux et stimuli environnementaux), des facteurs intrinsèques, y compris des signaux circulants liés à l’énergie (hormones, nutriments) et des entrées nerveuses afférentes provenant de la périphérie (axe vagal intestin-cerveau). Il est désormais établi que l’environnement alimentaire moderne a un impact considérable sur la capacité du cerveau à contrôler l’alimentation et la dépense énergétique. Bien que la surconsommation soit clairement identifiée comme le principal coupable, de nombreuses données indiquent que le développement de l’obésité et des troubles qui y sont liés résulte d’une interaction entre les gènes et l’environnement. Notre objectif est d’explorer les bases physiopathologiques de ces processus et d’identifier les composants moléculaires impliqués dans l’établissement de la susceptibilité/résilience à la récompense et aux troubles liés au métabolisme. Les 4 axes de recherche sont développés en commun et nous cherchons à ce que les ressources de l’équipe (humaines, scientifiques et techniques) soient interdépendantes, collaboratives et hautement mutualisées. Dans la continuité des efforts précédents, nous nous consacrons aux 4 axes suivants (voir représentation schématique et méthodologie détaillée).
Axes thématiques
Axe 1: Impact du statut métabolique sur l’intégration multisensorielle
Axe 2: Le rôle de l’astrocyte dans le contrôle métabolique
Axe 3: Déterminant moléculaires de la susceptibilité/résilience du cerveau aux maladies métaboliques.
Axe 4: Intégration dynamique des signaux intéroceptifs dans le contrôle de l’homéostasie énergétique et de la récompense.
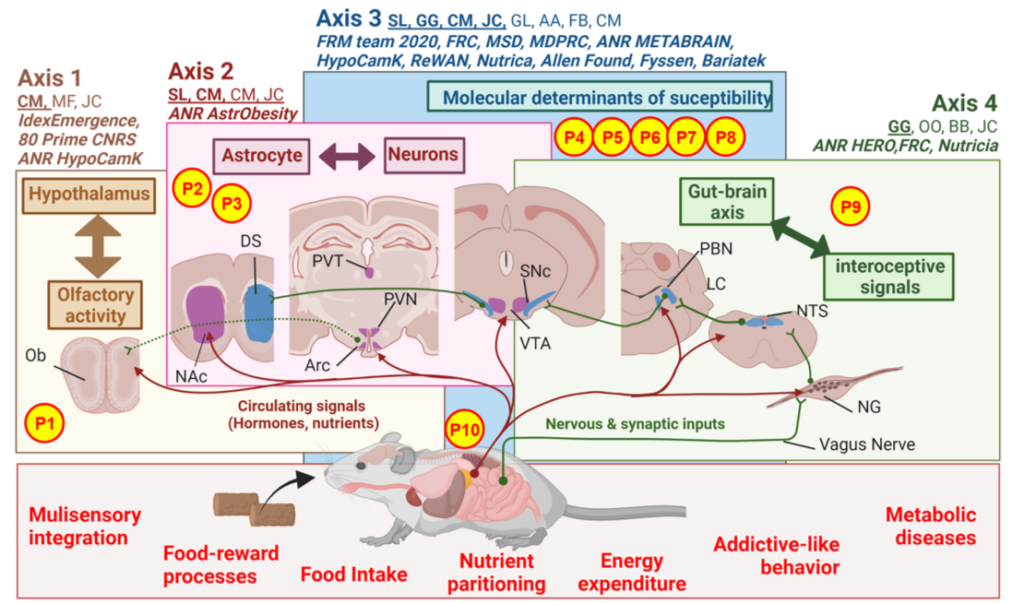
Légende
The C2OFFEE team main research axes and work force. Circulating (red) and nervous/synaptic signals (green) conveying energy states are integrated at various levels in the brain and reflect the bimodal dialogue between the brain and peripheral organs. Through 4 interdependent research axes the team explores: (1) the connection between hypothalamic encoding of hunger and multisensory/olfaction capacity, (2) the role of astrocytes in the hypothalamus and reward system in long-term adaptations to an obesogenic environment, (3) the genetic and molecular determinants that siege at brain susceptibility or resilience to the detrimental action of modern-food environment and (4) the functional networks and their cellular/molecular underpinnings trough which interoceptive signals and the extended gut-brain axis control metabolic efficiency, reward processes and addictive-like behaviors.
Work force: Serge Luquet (SL), Giuseppe Gangarossa (GG), Claire Martin (CM), Julien Castel (JC), Guangping Li (GL), Anthony Ansoult (AA), Fanny Bain (FB), Caroline Leger (CL), Maya Faour (MF), Oriane Onimus (OO), Nour Mesto (NMe), Benoit Bertrand (BB), Nejmeh Mashhour (NMa), Camille De Almeida (CdA), Claudia Grajeda (CG)
Abbreviation: Nodose Ganglia (NG), Arcuate nucleus (Arc), Paraventricular thalamus (PVT), Paraventricular nucleus (PVN), Nucleus Tractus Solitarius (NTS), Olfactory bulb (Ob), Ventral Tegmental Area (VTA), Substantia Nigra compacta (SNc), Dorsal Striatum (DS), Nucleus Accumbens (NAc), Parabrachial nucleus (PBN), Locus Coeruleus (LC)